|
La
3,4-metilendiossimetamfetamina (MDMA), la cui prima sintesi si
attribuisce al chimico tedesco Fritz Haber che nel 1898 ne
pubblicò il metodo, è il prototipo di un gruppo di
amfetamine caratterizzate dalla funzione 3,4-metilendiossi.
Con una terminologia introdotta da Nichols nel 1986, esse sono
dette "entattogene" per specificare in ragione
dell'etimo greco e latino la singolare tipologia dei loro
effetti. L'MDMA deve gran parte della sua popolarità al fatto
di essere illecitamente commercializzata come ecstasy, droga
ricreazionale in voga fra i giovani. Proveniente dalla
California, l'ecstasy ha raggiunto l'Europa attraverso Ibiza
dove all'inizio degli anni '80 si ballava al ritmo di
"house and garage music", generi musicali
antesignani della "techno" provenienti anch'essi
dagli Stati Uniti. Molti dee-jay che lavorarono in quegli anni
ad Ibiza, al ritorno nei loro paesi d'origine, fecero da
battistrada al fenomeno "rave" la cui diffusione è
avvenuta parallelamente a quella dell'ecstasy. La crescente
popolarità dell'ecstasy e la consapevolezza che in numerosi
modelli animali, compreso il primate non umano, l'MDMA
somministrata a dosi comparabili a quelle assunte dall'uomo a
scopo ricreazionale è in grado di alterare, forse in modo
permanente, l'architettura di specifiche parti del cervello,
costituiscono motivo di grande preoccupazione. Questo lavoro
descrive le attuali conoscenze intorno ad alcuni aspetti di un
fenomeno che rappresenta argomento di interesse per i
professionisti di questo settore della salute pubblica.
Gli
effetti sull'uomo e sull'animale da esperimento
Sebbene
brevettata dalla Merck fin dal 1914 gli effetti dell'MDMA
sull'uomo sono stati esaminati con attenzione soltanto a
partire dai primi anni '70, quando A. Shulgin risintetizzò la
molecola e ne sperimentò personalmente gli effetti. Egli si
rese conto che l'MDMA, assunta per os alla dose di 100/150mg,
pur conservando in forma attenuata l'azione stimolante tipica
delle amfetamine, induce un'esperienza piacevole che inizia a
manifestarsi dopo 20/30 minuti e si mantiene per 4/6 ore.
Questa condizione, simile ad un sentimento d'amore senza
esacerbazione del desiderio sessuale, è caratterizzata da
ansia difensiva ridotta, umore elevato, introspezione più
acuta e migliore capacità di articolazione di stati e
sensazioni, senza alterazione della percezione o difficoltà
di orientamento. In considerazione di questi effetti, definiti
entattogeni, molti psicoterapeuti statunitensi, dalla seconda
metà degli anni '70 fino al 1985, anno in cui la Drug
Enforcement Agency (DEA) ha inserito l'MDMA nella categoria
più restrittiva del Controlled Substance Act (CSA),
somministrarono la sostanza ai loro pazienti come farmaco
integrativo al trattamento. Alcuni di questi professionisti
sostengono ancor oggi che l'MDMA facilita il raggiungimento
dei risultati attesi con la psicoterapia, migliorandone
l'efficacia. Oltre agli effetti entattogeni, l'MDMA manifesta
nell'uomo azione antifame ed antifatica e provoca aumento di
frequenza cardiaca, pressione arteriosa e temperatura
corporea, nonché midriasi, secchezza alle fauci e tensione
alla mascella. Nel ratto l'MDMA incrementa l'attività
locomotoria orizzontale, la temperatura corporea e la
frequenza cardiaca.
Nel
cane, dosi fra 2 e 10 mg/kg di peso, causano midriasi,
salivazione, piloerezione, ipertermia. Dosi molto elevate di
MDMA provocano convulsioni in ratto, cane e scimmia e la LD50
nel topo è compresa fra 80 e 115 mg/kg di peso. Gli studi di
"drug discrimination" dimostrano che essa
sostituisce la d-amfetamina nel ratto, nel piccione e nella
scimmia allenati a discriminare quest'ultima dalla soluzione
salina. Al contrario l'MDMA non sostituisce la 2,5
dimetossi-4-metamfetamina (DOM). Negli studi di "self
administration" alla stessa maniera degli eccitanti e
differentemente rispetto agli allucinogeni gli animali
mostrano propensione ad autosomministrarsi l'MDMA. Queste
osservazioni confermano che essa presenta significativa
attività stimolante e che, almeno per quanto riguarda i
modelli sperimentali, è maggiormente assimilabile alle
sostanze eccitanti tipo d-amfetamina rispetto a quelle
allucinogene tipo DOM.
Il meccanismo d'azione: elementi di analisi e
considerazioni
L'utilizzo
della microdialisi cerebrale che, mediante impianto
stereotassico di sottilissime fibre da dialisi, consente di
misurare nell'animale sveglio e libero di muoversi le
modificazioni neurotrasmettitoriali indotte in specifiche aree
cerebrali dalla somministrazione di una sostanza, ha
dimostrato che l'MDMA determina significativo aumento della
concentrazione extracellulare di serotonina (5HT) nello
striato (fig.
1) e nella corteccia cerebrale (fig.
2).
Tale
incremento, il cui andamento ben si correla alla durata degli
effetti attribuibili alla sostanza, è dose dipendente e
risulta esser potenziato dal pretrattamento con un precursore
della 5HT (fig.
3) come il 5-idrossitriptofano (5HTP). Inoltre esso è
attenuato dalla cosomministrazione di un inibitore della
ricaptazione della 5HT come la fluoxetina (fig.
4) mentre non è affatto influenzato dalla
co-somministrazione di un bloccante il potenziale d'azione
come la tetrodotossina (fig.
5).
L'analisi
di questi dati, oltre a mostrare che l'incremento di
concentrazione extracellulare di 5HT indotto dall'MDMA può
essere potenziato stimolandone preventivamente la sintesi,
suggerisce che, in ragione dell'attenuazione determinata dalla
fluoxetina, la liberazione di 5HT nello spazio intersinaptico
è mediata dal "carrier" di membrana per la
ricaptazione del trasmettitore e che, considerata
l'inefficacia della tetrodotossina nel bloccare tale
liberazione, essa è indipendente dal meccanismo fisiologico
di conduzione dell'impulso nervoso. La microdialisi cerebrale
ha inoltre confermato che, sebbene le modificazioni
neurochimiche determinate dall'MDMA interessano
prevalentemente il sistema serotoninergico, essa interagisce
anche con quello dopaminergico provocando l'aumento della
concentrazione extracellulare di dopamina (DA) nello striato (fig.6).
La struttura molecolare delle amfetamine permette di ottenere
derivati farmacologicamente assai differenti mediante
sostituzioni su anello aromatico, catena laterale e gruppo
aminico terminale. Gli effetti neurochimici indotti dall'MDMA
si correlano alle sue caratteristiche molecolari (fig.7).

Essa
è bisostituita sull'anello in posizione 3-4 con la funzione
metilendiossi ed è un'amina secondaria; possedendo un centro
chirale sul carbonio a, esiste nei due isomeri ottici
destrogiro S-(+) e levogiro R-(-) il primo dei quali (fig. 8)
risulta essere il più efficace.

Le
amfetamine che esercitano una potente azione stimolante
centrale, come d-amfetamina e metamfetamina, al pari dell'MDMA
sono più attive in forma destrogira. Viceversa quelle dotate
di effetto allucinogeno, come la DOM, sono più efficaci come
isomeri levogiri, sono caratterizzate dalla funzione metossi,
sono generalmente trisistituite sull'anello in posizione 3-4-5
o 2-4-5 e sono amine primarie. Questi dati suggeriscono che le
sostituzioni sull'anello aromatico condizionano lo spostamento
dell'azione farmacologica dal sistema dopaminergico a quello
serotoninergico, che la bisostituzione sull'anello con la
funzione 3,4-metilendiossi favorisce, rispetto a
trisostituzione e funzione metossi, la perdita delle
proprietà allucinogene e l'acquisizione di quelle entattogene
ed infine che le residue attività allucinogene sono
indebolite ulteriormente dalla sostituzione sul gruppo aminico
terminale: infatti mentre la metilendiossiamfetamina (MDA)
(Fig.9), che è un'amina primaria conserva in misura ancora
significativa questa proprietà, l'MDMA ne risulta quasi
sprovvista.
Sulla
base degli effetti farmacologici e della struttura molecolare
di ciascun derivato, le amfetamine possono dunque esser
distinte in stimolanti (prototipo: metamfetamina),
allucinogene (prototipo: DOM) ed entattogene (prototipo: MDMA)
riconoscendo ciascuno dei tre gruppi uno specifico meccanismo
d'azione.
Le amfetamine stimolanti interferiscono con l'immagazzinamento
vescicolare della DA ed inibiscono le monoaminossidasi (MAO):
entrambe queste azioni aumentano la concentrazione
citoplasmatica di DA e conseguentemente quella nello spazio
intersinaptico. Le metossiamfetamine allucinogene per le loro
caratteristiche steriche ed elettrostatiche interagiscono con
i recettori 5HT2A e 5HT2C. Per quanto riguarda le amfetamine
entattogene, sebbene l'MDMA mostri affinità per il sito di
"uptake"

della
5HT e, nell'ordine, per i recettori a 2, 5-HT2 ed M1, sulla
base dei dati sopra riportati si ritiene che la sua azione sul
sistema serotoninergico sia assimilabile a quella delle
amfetamine eccitanti a livello del sistema dopaminergico. L'MDMA
penetra nel terminale sinaptico probabilmente in scambio con
la 5HT e blocca il "carrier" per il trasporto del
neurotrasmettitore all'interno delle vescicole che si trovano
nel bulbo terminale dell'assone serotoninergico.
Contestualmente essa inibisce le MAO e più significativamente
l'isoenzima A rispetto al B. In questo modo la concentrazione
della 5HT nel citoplasma supera quella nello spazio sinaptico
e si determina un'inversione della direzione di trasporto del
"carrier" di membrana per cui la 5HT accumulata nel
citoplasma si riversa, con meccanismo calcio-indipendente,
nellospazio intersinaptico.
Per
quanto riguarda la DA l'aumento della sua concentrazione
extracellulare è indotto dall'MDMA sia direttamente che
indirettamente per azione della 5HT sul recettore
postsinaptico 5HT2A/C posto su un interneurone inibitorio
GABA. La stimolazione di questo recettore si risolve nella
diminuzione della trasmissione gabaergica che incrementa
sintesi e rilascio di DA.
All'iniziale
effetto di stimolo della trasmissione serotoninergica segue
l'effetto opposto per inibizione della triptofano-idrossilasi
(TPH), enzima fondamentale per la sintesi della 5HT; la
diminuzione della concentrazione dell'acido
5-idrossiindolacetico (5HIAA), che si può dimostrare nel
liquor in questa fase, è indicativa dell'abbassamento della
funzione serotoninergica.
L'assorbimento
dell'MDMA somministrata per os è rapido e nell'uomo il picco
plasmatico si raggiunge in circa 2 ore. L'emivita plasmatica
è intorno alle 6-7 ore ed in 72 ore il 72% della dose
somministrata è eliminata con le urine. Nel ratto l'emivita
è stimata in circa 70 minuti per l'isomero destrogiro S-(+)
ed in circa 100 minuti per quello levogiro R-(-). Nel cane il
legame alle proteine plasmatiche è indipendente dalla dose e
varia dal 34 al 40%. Il metabolita principale della MDMA è la
MDA; la più importante via di metabolizzazione di entrambe è
la N-demetilazione in catelcolderivati successivamente
ossidati in chinoni. L'N-demetilazione è una reazione
ossidativa catalizzata dal sistema P-450 ed è possibile che
attraverso l'isoenzima CYP2D6 esistano metabolizzatori rapidi
e lenti. Pur non potendosi escludere che differenze
metaboliche condizionino la comparsa di manifestazioni
tossiche, nel ratto Dark Agouti le alterazioni indotte dall'MDMA
sono comparabili nei due sessi, sebbene il metabolismo CYP2D6
sia significativamente più veloce nei maschi rispetto alle
femmine.
La
questione della neurotossicità: dati nei modelli animali ed
osservazioni sull'uomo
In numerose specie animali l'MDMA manifesta caratteristica
azione neurotossica sui sottili terminali assonali dei neuroni
serotoninergici i cui corpi cellulari si trovano nel nucleo
del rafe dorsale, risparmiando quelli di maggior diametro che
originano nel nucleo del rafe mediano. Il metodo di
Fink-Heimer mostra l'impregnazione argentica degli assoni
degenerati. La degenerazione inizia entro poche ore
dall'ultima somministrazione di MDMA e persiste molti mesi.
Essendo risparmiati i pirenofori gli assoni sono in grado di
essere rigenerati. L'autoradiografia dei siti di "uptake"
della 5-HT e lo studio immunocitochimico degli assoni reattivi
hanno evidenziato che la reinnervazione che si osserva nel
ratto albino e soprattutto nella scimmia scoiattolo 12/18 mesi
dopo la somministrazione, rispettivamente per via i.p. ed s.c.
di 5 mg di MDMA, due volte al giorno per quattro giorni, segue
un modello anormale. Essa è caratterizzata da
riorganizzazione delle proiezioni assonali ascendenti
serotoninergiche, con denervazione della neocorteccia dorsale
ed iperinnervazione di amigdala ed ipotalamo. Da tutti i
modelli sperimentali, ad eccezione del topo con il quale si
sono ottenuti risultati non sempre univoci, risulta che la
somministrazione di MDMA in un'unica dose elevata o dopo
trattamenti ripetuti determina riduzione di 5-HT cerebrale,
5-HIAA liquorale ed attività triptofano-idrossilasica.
La
perdita del contenuto cellulare di 5HT avviene in due fasi. La
prima coincide col rilascio acuto di 5HT dopo il quale le
concentrazioni si rinormalizzano nell'arco di 24 ore. La
seconda corrisponde alla diminuzione a lungo termine del
contenuto di 5HT; essa si instaura nel giro di tre giorni e,
sostenuta dal persistente decremento dell'attività triptofano
idrossilasica, si mantiene per oltre un anno. Nel primate non
umano, più sensibile del ratto agli effetti neurotossici
dell'MDMA, le alterazioni si osservano anche dopo
somministrazione orale e piccoli aumenti di dose causano
incrementi cospicui nella deplezione di 5HT. Le diminuzioni
più forti si evidenziano nella neocorteccia, nello striato e
nell'ippocampo; le più lievi si riscontrano a livello di
tronco encefalico ed ipotalamo. Immagini PET del cervello di
babbuino hanno recentemente fornito una ulteriore conferma di
questo modello di tossicità.
Numerose
ricerche sui roditori hanno tentato di indagare le conseguenze
comportamentali della neurotossicità serotoninergica. Animali
trattati con dosi di MDMA che determinano una riduzione fra il
35% ed il 70% dei livelli di 5-HT nello striato e
nell'ippocampo non evidenziano cambiamenti significativi in
"emergence", "hot plate response", "auditory
startle", "complex maze performance", "one
and two way avoidance", "swim test" ed "eight
radial arm maze". è stato invece dimostrato che
diminuiscono le vocalizzazioni ultrasoniche dei piccoli dei
ratti dopo la separazione dalla madre.
I
modelli comportamentali risentono dell'assenza di specificità
per il sistema serotoninergico, dato che presumibilmente molti
neurotrasmettitori sottendono i comportamenti osservati.
Mancando una specifica misura comportamentale per la funzione
di 5-HT è difficile trarre conclusioni e l'estensione della
tossicità MDMA indotta può essere insufficiente a
determinare modificazioni significative, considerando che nei
modelli di neurodegenerazione tipo Parkinson non si osservano
cambiamenti finché non vengono distrutte il 70-80% delle
terminazioni dopaminergiche.
Da quando MDMA di sintesi clandestina è commercializzata come
droga l'eventuale neurotossicità per l'uomo è motivo di
preoccupazione, pur tenendo conto che le preparazioni di
ecstasy possono effettivamente contenere MDMA o molecole
analoghe, non contenerla affatto, oppure ancora essere
contaminate da altri principi tossici di per sé. Considerando
che le sequele osservate sull'uomo sono da attribuirsi
all'ecstasy e che nella maggior parte degli studi che hanno
riscontrato neurodegenerazione negli animali l'MDMA è
somministrata per vie diverse da quella orale, a dosi cospicue
ed in limitati intervalli di tempo, il passaggio dall'animale
all'uomo rimane vago ed incerto. Ciò non toglie che:
1)
dosi elevate di ecstasy somministrate ripetutamente sono
correlate nell'uomo ad una diminuzione del 25% dei livelli di
5-HIAA nel liquido cerebrospinale;
2) l'uso cronico di ecstasy può condurre ad
alterazioni nei cicli del sonno ed è stato dimostrato che la
risposta prolattinica a L-triptofano viene diminuita;
3) numerosi resoconti hanno attribuito all'assuzione
di ecstasy lo sviluppo di anomalie neuropsichiatriche acute e
croniche che comprendono disturbi da panico, depressione e
psicosi. Del tutto recentemente (1998) in 15 giovani
consumatori di ecstasy è stato dimostrato un significativo
decremento del trasportatore di membrana della 5HT misurato
alla PET mediante l'MCN-5652 radioligando selettivo per il
"carrier". Queste osservazioni suggeriscono che
negli esseri umani il sistema serotoninergico può essere
influenzato dall'assunzione di ecstasy, ricordando tuttavia
che la maggior parte dei consumatori di droghe ricreazionali
sono poliabusatori e che i loro "self-report" sono
di dubbia affidabilità.
A
fronte di queste incertezze vi sono i dati di una indagine di
Fase 1, a doppio cieco con controllo placebo, sugli effetti
dell'MDMA nell'uomo autorizzata dalla Food and Drug
Administration (FDA) ed avviata a partire dal maggio 1994
presso l'Harbor-UCLA Medical Center di Torrance in California.
I partecipanti a questa ricerca sono stati sottoposti a
scansioni con spettroscopia RM e SPECT i cui risultati sono
compatibili con alterazioni della neurochimica cerebrale e
della perfusione sanguigna in particolare nella corteccia
visiva del lobo occipitale.
|
Il meccanismo di
neurodegenerazione
|
Danno assonale ed inattivazione del TPH non possono essere
attribuiti né ai prodotti metabolici dell'MDMA né a quelli
della 5HT. La DA è chiaramente implicata nel meccanismo
neurotossico dell'MDMA. Esiste una correlazione lineare tra
rilascio acuto di DA e danno a lungo termine delle
terminazioni serotoninergiche. Il pretrattamento con
a-metil-para-tirosina, inibitore della sintesi di DA, attenua
l'alterazione degli assoni serotoninergici e la distruzione
delle terminazioni dopaminergiche con la neurotossina 6-OH-DA
determina la completa protezione dalla neurotossicità da MDMA.
 Per
converso si osserva un aumento della neurotossicità indotta
da MDMA, in seguito a pretrattamento con L-DOPA. Mentre il
danno neuronale è potenziato dalla DA, la preventiva
somministrazione di triptofano (TP) o 5-idrossitriptofano
(5-OHTP) aumenta il rilascio extraneuronale di 5HT dopo MDMA
ma previene, invece che incrementare, la neurotossicità. Il
5-metossi-6-metil-2-aminoindano, molecola sprovvista di azione
intrinseca sulla DA, provoca selettivamente liberazione e
successiva deplezione di 5HT, senza tossicità per il sistema
serotoninergico se non somministrato in combinazione con
(+)-amfetamina. é noto da tempo che la fluoxetina,
somministrata fino a sei ore dopo l'MDMA, ne attenua
significativamente la neurotossicità e più recentemente si
è accertato che il "carrier" di membrana per
l'"uptake" della 5HT, in mancanza di quest'ultima,
riconosce come substrato anche la DA. Importanti evidenze
riguardano il ruolo dello stress ossidativo. Per
converso si osserva un aumento della neurotossicità indotta
da MDMA, in seguito a pretrattamento con L-DOPA. Mentre il
danno neuronale è potenziato dalla DA, la preventiva
somministrazione di triptofano (TP) o 5-idrossitriptofano
(5-OHTP) aumenta il rilascio extraneuronale di 5HT dopo MDMA
ma previene, invece che incrementare, la neurotossicità. Il
5-metossi-6-metil-2-aminoindano, molecola sprovvista di azione
intrinseca sulla DA, provoca selettivamente liberazione e
successiva deplezione di 5HT, senza tossicità per il sistema
serotoninergico se non somministrato in combinazione con
(+)-amfetamina. é noto da tempo che la fluoxetina,
somministrata fino a sei ore dopo l'MDMA, ne attenua
significativamente la neurotossicità e più recentemente si
è accertato che il "carrier" di membrana per
l'"uptake" della 5HT, in mancanza di quest'ultima,
riconosce come substrato anche la DA. Importanti evidenze
riguardano il ruolo dello stress ossidativo.
Infatti
l'MDMA incrementa la formazione di sostanze reattive all'acido
tiobarbiturico ed il reagente "spin trap"
a-fenil-N-ter-butyl-nitrone, che inattiva i radicali liberi,
previene la neurodegenerazione da MDMA.

E'
suggestivo
che la deplezione di 5HT dai neuroni serotoninergici renda i
terminali vulnerabili e che la DA trasportata dal "carrier"
per l'"uptake" della 5HT dal pool extracellulare
incrementato all'interno del terminale serotoninergico depleto
di 5HT sia deaminata dalle MAO-B di cui quest'ultimo è
primariamente provvisto. Il metabolismo della DA nelle
terminazioni serotoninergiche genera perossido di idrogeno in
misura superiore alle capacità riduttive della cellula
provocando perossidazione lipidica, stress ossidativo
generalizzato e degenerazione selettiva degli assoni. In
effetti il pretrattamento con l-deprenil o con MDL-72974
inibitori delle MAO-B protegge dagli effetti neurotossici di
40 mg/kg di MDMA in singola dose. Nel terminale
serotoninergico la MAO-B sembra giocare un ruolo protettivo
degradando neurotrasmettitori estranei: in normali condizioni
la deaminazione da parte della MAO-B di DA estranea, che può
occasionalmente entrare nel terminale serotoninergico, ha
minime conseguenze essendo la capacità riduttiva del neurone
sufficiente a neutralizzare bassi livelli di ossidanti.
Il
trattamento con MDMA supera la capacità del neurone di
distruggere le specie ossidative, determinando tossicità.
Analogamente l'inattivazione di TPH potrebbe essere causata
dall'ossidazione dei gruppi tiolici della sua molecola e si
suppone che la fase di reversibilità a breve termine
dell'attività idrossilasica sia effetto di un meccanismo di
inibizione enzimatica mentre la riduzione a lungo termine più
propriamente rifletta la degenerazione assonale. Considerando
che il sistema gabaergico modula l'attività dopaminergica
questo modello non contrasta con l'osservazione che l'agonista
GABA clormetiazolo attenua la neurotossicità da MDMA.
Al
momento attuale invece non vi sono dati sufficientemente
convincenti intorno al ruolo di glutammato e nitrossido nel
meccanismo neurotossico dell'MDMA. Un importante argomento di
indagine riguarda l'implicazione della temperatura ambientale
nei processi neurotossici da MDMA. Molti laboratori hanno
dimostrato che quando l'MDMA viene somministrata all'animale
alla temperatura ambientale di 24°C (o più alta) vi è
ipertermia mentre a 10°C c'è risposta ipotermica. Gli
effetti dell'MDMA sulla temperatura corporea sembrano
direttamente correlati alla temperatura ambientale.
L'ipertermia
è nell'uomo uno dei più gravi effetti collaterali associati
all'uso di ecstasy mentre l'ipotermia protegge contro i danni
cerebrali indotti da una grande varietà di cause. Gli animali
stabulati in ambiente freddo diminuiscono sia il rilascio di
DA che la neurotossicità da amfetamina. Allo stesso modo si
potrebbe ipotizzare che la riduzione di temperatura corporea
diminuisca gli effetti neurochimici dell'MDMA fornendo
indirettamente protezione nei confronti dei suoi effetti
tossici.
Ecstasy:
stima aggiornata sui danni alla salute
Le
preparazioni da strada
 Di
facile sintesi a partire da precursori reperibili senza
difficoltà, l'ecstasy ha un costo relativamente basso rispetto alle droghe d'abuso classiche. In Europa, il traffico di
ecstasy ha il suo centro di smistamento in Olanda, mentre la
sintesi del principio attivo e la preparazione in compresse
avvengono soprattutto nei Paesi dell'Est. In Italia il
4-allil-1, 2-metilendiossibenzene (safrolo) è considerato il
principale precursore: usato come olio di sassofrasso per
aromatizzare cosmetici e saponi, è di facile
approvvigionamento nonostante la legislazione in tema di
sostanze stupefacenti preveda l'obbligo di segnalazione della
vendita dei prodotti utilizzabili per la loro sintesi chimica.
Già nel 1989, a Massa Carrara, in un laboratorio clandestino
fu rinvenuto safrolo sufficiente a preparare 15.000 compresse
di ecstasy, ciascuna da 100 mg di principio attivo. Come
precedentemente osservato le compresse sono spesso miscugli di
MDMA, MDA, MDEA (3,4-metilenediossietilamfetamina) o MBDB
(N-metil-1-(1,3-benzodiossol-s-il)-2-butanamina) in quantità
ed in proporzioni variabili; esse possono contenere impurità
di fabbricazione come acetato di piombo o safrolo ed essere
tagliate con prodotti diversi come zucchero in polvere e
caffeina o con altre sostanze psicoattive come LSD e
amfetamine (fig.10). Di
facile sintesi a partire da precursori reperibili senza
difficoltà, l'ecstasy ha un costo relativamente basso rispetto alle droghe d'abuso classiche. In Europa, il traffico di
ecstasy ha il suo centro di smistamento in Olanda, mentre la
sintesi del principio attivo e la preparazione in compresse
avvengono soprattutto nei Paesi dell'Est. In Italia il
4-allil-1, 2-metilendiossibenzene (safrolo) è considerato il
principale precursore: usato come olio di sassofrasso per
aromatizzare cosmetici e saponi, è di facile
approvvigionamento nonostante la legislazione in tema di
sostanze stupefacenti preveda l'obbligo di segnalazione della
vendita dei prodotti utilizzabili per la loro sintesi chimica.
Già nel 1989, a Massa Carrara, in un laboratorio clandestino
fu rinvenuto safrolo sufficiente a preparare 15.000 compresse
di ecstasy, ciascuna da 100 mg di principio attivo. Come
precedentemente osservato le compresse sono spesso miscugli di
MDMA, MDA, MDEA (3,4-metilenediossietilamfetamina) o MBDB
(N-metil-1-(1,3-benzodiossol-s-il)-2-butanamina) in quantità
ed in proporzioni variabili; esse possono contenere impurità
di fabbricazione come acetato di piombo o safrolo ed essere
tagliate con prodotti diversi come zucchero in polvere e
caffeina o con altre sostanze psicoattive come LSD e
amfetamine (fig.10).
Il profilo del consumatore
 I
consumatori d'ecstasy sono considerati "recreational drug
user", espressione che definisce le persone che assumono sostanze in relazione a precisi tipi di divertimento come i
"rave" nel caso specifico; spesso sono avvezzi ad
assumere le pasticche con altre sostanze e sono suscettibili
di sperimentare droghe per fumo o per sniffo evitando
generalmente la via intravenosa. Per quanto riescano per lo
più ad evitare una grave compromissione sociale e non si
considerino tossicomani, riconoscono spesso che l'uso della
sostanza ha comportato per loro conseguenze negative di vario
genere. I
consumatori d'ecstasy sono considerati "recreational drug
user", espressione che definisce le persone che assumono sostanze in relazione a precisi tipi di divertimento come i
"rave" nel caso specifico; spesso sono avvezzi ad
assumere le pasticche con altre sostanze e sono suscettibili
di sperimentare droghe per fumo o per sniffo evitando
generalmente la via intravenosa. Per quanto riescano per lo
più ad evitare una grave compromissione sociale e non si
considerino tossicomani, riconoscono spesso che l'uso della
sostanza ha comportato per loro conseguenze negative di vario
genere.
Non
di rado l'intensificarsi delle assunzioni favorisce la
comparsa degli effetti spiacevoli e sebbene si conoscano casi
di abuso importante non sembra esistere una reale condizione
di tossicomania. Nella pratica clinica sono giunti alla nostra
osservazione consumatori di ecstasy della più diversa
provenienza socio-demografica e ci siamo confrontati tanto con
situazioni di assunzione programmata o rituale quanto con casi
di abuso ripetitivo alla ricerca di effetti precisi in
risposta a situazioni di malessere.
Gli effetti avversi
Le
complicazioni segnalate nell'uomo in seguito all'assunzione di
ecstasy riguardano tutto sommato un numero esiguo di persone
rispetto al gran numero di utilizzatori. Sulla base dei casi
riportati in letteratura si tengono distinte le complicanze
sistemiche acute dagli effetti neuropsichiatrici indesiderati
subacuti e cronici. Le prime costituiscono la temibile
sindrome da intossicazione acuta, che può manifestarsi non
solo alla prima assunzione ma anche in consumatori abituali.
Il quadro clinico è caratterizzato da irrequietezza,
confusione mentale, alterazione della coscienza, iperriflessia,
mioclono, convulsioni, pallore cutaneo, piloerezione,
midriasi, secchezza alle fauci e sintomi gastro-intestinali
tipo nausea e diarrea. Nei casi più gravi si osserva
rabdomiolisi con mioglobinuria, insufficienza renale acuta
(IRA), coagulazione intravascolare disseminata (CID) ed
ipertermia la cui insorgenza è favorita non solo dalla
sostanza ma anche dall'attività fisica prolungata (il ballo)
in ambienti sovraffollati, caldo-umidi e con ventilazione
insufficiente. Frequenza cardiaca e pressione arteriosa sono
elevate, e possono presentarsi severe aritmie con ipotensione
fino allo shock. Per molti di questi effetti manca una chiara
correlazione con la dose di sostanza assunta. L'epatotossicità,
sporadicamente segnalata, è attribuibile più a contaminanti
ed impurità, presenti nelle preparazioni da strada, che non
propriamente al principio attivo, anche se ipertermia e CID
possono correlarsi con compromissione epatica.
|
La prognosi sembra legata alla rapidità del controllo
dell'ipertermia ed il trattamento deve essere posto in
atto entro le prime ore dopo l'assunzione; esso è
finalizzato al mantenimento delle funzioni vitali ed al
controllo della sintomatologia. La gastrolusi, seguita
dalla somministrazione di carbone attivo, è efficace
solo se tempestiva.
L'MDMA sembra provocare il rilascio di ormone
antidiuretico (ADH) e la contrazione della diuresi,
accompagnata dalla tendenza compulsiva a bere liquidi,
può contribuire alla comparsa di edema cerebrale.
|
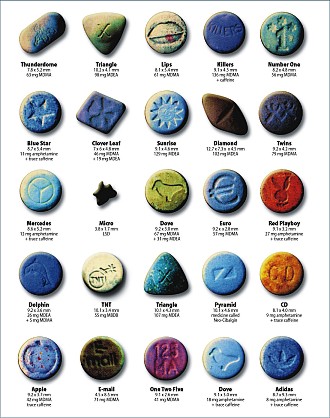
Fig. 10 Alcuni tipi di
pastiglie di Ecstasy
|
Le
bevande isotoniche ed i fluidi salini riducono il rischio di
eccessivo assorbimento cellulare di acqua e favoriscono il
ripristino dell'equilibrio idroelettrolitico. E'
sconsigliabile incrementare la velocità di eliminazione
renale della sostanza mediante diuresi forzata acida.
L'eccessiva contrattilità muscolare con distruzione delle
miofibre potrebbe essere una delle cause dell'ipertermia e
l'acidificazione delle urine in presenza di mioglobinuria
favorisce l'insufficienza renale. Per il controllo
dell'ipertermia il dantrolene, calcioantagonista ad azione
squisitamente periferica, si è rivelato efficace in molti
casi ma almeno in prima battuta sono preferibili i
tradizionali mezzi fisici. Non devono invece essere
somministrati salicilati antipiretici che possono aggravare
l'ipertermia. Sono utili anticonvulsivi e sedativi, preferendo
le benzodiazepine (BDZ) ai neurolettici considerato il rischio
di sindrome maligna. Superate le prime 72 ore dall'episodio
acuto, qualora permangano sintomi premonitori degli effetti
neuropsichiatrici subacuti, può essere indicato favorire la
trasmissione serotoninergica mediante gli inibitori della
ricaptazione di 5HT (SSRI). Gli effetti subacuti, la cui
durata deve per definizione essere inferiore ad un mese, sono
insonnia, sonnolenza, anoressia, depressione, ansia ed
irritabilità. Verosimilmente questi disturbi dipendono dalla
diminuzione di TPH e quindi di 5HT e dalla ricaptazione di DA
nelle cellule presinaptiche dove essa agirebbe come
neurotossina. Sulla base dell'evidenza sperimentale
sembrerebbe opportuno utilizzare gli SSRI per diminuire la
ricaptazione della DA ed evitare nel contempo la caduta
improvvisa della concentrazione di 5HT nello spazio
intersinaptico, finché non si ripristinino i livelli normali
di TPH. La moderata e temporanea somministrazione di BDZ trova
indicazione per il trattamento sintomatico della maggior parte
degli altri sintomi che caratterizzano la tossicità sabacuta.
Non
di rado in soggetti con anamnesi positiva per uso di ecstasy
si riscontrano crisi ricorrenti di panico,
"flashback", turbe della memoria, difficoltà di
concentrazione e di apprendimento, depressione. Attualmente è
possibile formulare ipotesi di trattamento più che offrire un
efficace arsenale terapeutico ma la fluoxetina somministrata a
dosaggi elevati e per lunghi periodi si è dimostrata in molti
casi capace di contenere queste manifestazioni
neuropsichiatriche indesiderate. In relazione alla
sintomatologia presentata, molti altri farmaci possono essere
vantaggiosamente impiegati secondo le loro classiche
indicazioni.
Le ricerche intorno alle proprietà farmacotossicologiche
dell'MDMA hanno affinato le conoscenze intorno a 5-HT, DA, MAO
ed alla rispettiva influenza su umore, ansia, dolore, sonno,
appetito, personalità, apprendimento. Resta imperativo
stabilire se, e in che modo, questa sostanza sia neurotossica
per l'uomo. Attualmente il concetto della neurotossicità
dell'MDMA e correlati si fonda su numerose evidenze
sperimentali ottenute sul modello animale, ma è noto che
l'estrapolazione all'uomo di questi dati è per definizione
oggetto di critica. Nell'animale da esperimento si impiegano
talora dosi più alte rispetto a quelle assunte dall'uomo, la
via di introduzione spesso è diversa (non orale) e le
somministrazioni vengono ripetute in tempi brevi. Tuttavia
l'uomo è assai più sensibile del ratto agli psicofarmaci ed
il suo sistema metabolico è di gran lunga meno efficiente,
per cui si può ipotizzare che nel cervello umano si producano
concentrazioni di principio attivo assai vicine a quelle
neurotossiche per l'animale. In aggiunta non va trascurato il
dato inequivocabile della maggior suscettibilità agli effetti
neurotossici di MDMA e congeneri del primate non umano
rispetto al ratto. La dimostrazione che il "pattern"
rigenerativo delle proiezioni serotoninergiche ascendenti
presenta, soprattutto nella scimmia, profonde alterazioni
rispetto alla norma, avvalora ancora di più gli attuali
timori, tanto più che questi dati sembrano trovare indiretta
conferma nelle osservazioni effettuate sull'uomo mediante
tecniche di neuroimmagine. Non si può escludere che solo in
alcuni individui particolarmente vulnerabili venga superata la
soglia di evidenza clinica del danno neuronale, ma neppure che
nell'uomo la neurotossicità possa manifestarsi in maniera
lenta ed insidiosa. Esiste poi la possibilità che nel tempo
preparazioni e modalità di assunzione di queste sostanze
subiscano modificazioni tali da ribaltare completamente
l'attuale opinione intorno alle proprietà tossicomanigene
dell'ecstasy cos" come in un recente passato è avvenuto
per la cocaina.Fin dal dicembre 1996 l'ONU ha fatto osservare
mediante una nota informativa che i derivati amfetaminici
costituiranno con ogni probabilità uno dei principali
problemi di droga del prossimo secolo. La semplicità della
loro struttura, la grande facilità di ottenere i precursori
necessari e l'accessibilità delle informazioni relative alla
fabbricazione sono altrettanti fattori che certamente non
facilitano le azioni preventive. L'ONU ha proposto un
rafforzamento delle sanzioni previste per la fabbricazione e
il traffico di queste sostanze ed ha chiesto con forza ai
governi di fare in modo che gli ingredienti di base siano meno
accessibili. Negli ultimi anni molti governi europei hanno
optato per una politica di "harm reduction"(riduzione
dei rischi) con lo scopo d'informare e mettere in opera
diversi mezzi per limitare le conseguenze che possono
accompagnare il consumo di ecstasy in attesa che, come è
auspicabile, siano concordemente messe a punto misure più
efficaci per contrastare la diffusione di queste sostanze.
Fischer
C, Hatzidimitrion G, Wlos J, Ricaurte G. Reorganization of
ascending 5-HT axon projections in animals previously exposed
to the recreational drug (±)3,4-methylenedioxymethamphetamine
(MDMA, "Ecstasy"). J. of Neuroscience. 15: 5476-5484, 1995.
Gessa GL. Ecstasy: meccanismo d'azione e
neurotossicità. Medicina delle tossicodipendenze. vol. 2 (4):
44-46, 1994.
Greer G,
Tolbert R. Subjective reports of effects of MDMA in a clinical
setting, J. Psychoact. Drugs. 18: 319-328, 1986.
Grob C,
Poland R, Chang L, Ernst T. Psycobiologic effects of
3,4-methylenedioxymethamphetamine in humans: methodological
considerations and preliminary observations. Behavioural Brain
Research. 73: 103-107, 1996.
Gudelsky GA and Nash JF. Carrier-mediated release of serotonin
by 3, 4-methylenedioxymethamphetamine: implications for
serotonin-dopamine interactions. J. of Neurochemistry. 66,
243-249, 1996.
McCann UD, Szabo Z Scheffel U, Dannals RF, Ricaurte GA. Positron emission tomographicevidence of toxic effect
of MDMA ("ecstasy") on brain serotonin neurons in
human beings. Lancet. 352 (9138): 1433-1437, 1998.
McCann UD, Ricaurte GA. Lasting neuropsychiatric sequelae of
methylenedioxymethamphetamine ("Ecstasy") in
recreational users. J. Clin. Psychopharmacol. 11: 302-305, 1991.
Nichols DE and Oberlender R. Structure activity relationships
of MDMA-like substances. NIDA Research Monographs. 94: 1-29,
1989.
Rattray M. Ecstasy: towards an understanding of the
biochemical basis of the actions of MDMA. Essay Biochem. 26:
77-87, 1991.
Sprague JE, Nichols DE. The monoamine oxidase inhibitor
l-deprenyl protects against 3,4-methylenedioxymethamphetamine
induced lipid peroxidation and long term serotoninergic
deficits.
J. Pharmacol. Exp. Ther. 273, 667-673, 1995.
Steele TD, McCann UD,
Ricaurte GA. 3, 4-Methylenedioxymethamphetamine (MDMA,
"Ecstasy"): pharmacology and toxicology in animals
and humans. Addiction. 89: 539-551, 1994.
Sprague JE, Shannon LE and Nichols DE. An integrated hypothesis for the serotonergic axonal
loss induced by 3,4-methilendioxymethamphetamine. NeuroToxicology.
19(3): 427-442, 1998.

|